在2025年9月18日,由上海市浦东新区科学技术协会、上海市浦东新区生物产业行业协会、上海浦东生命科学产业发展有限公司、博济医药科技股份有限公司主办,创思立信数字科技股份有限公司和美国汉弗莱医药顾问有限公司共同承办的“全球协同创新:引领药物开发新时代”主题沙龙在上海张江生命科学展厅圆满举办。来自监管机构、创新药企及行业服务机构的30余位专家齐聚一堂,围绕全球同步开发(GDD, Global Drug Development)的战略与实践展开深入探讨。

(生物医药沙龙 | 全球协同创新:引领药物开发新时代)
全球同步开发:创新药企的战略必答题
随着药物研发的全球化趋势日益明显,全球同步开发(GDD)正逐渐成为创新药企的核心战略选择。通过在多个国家同步开展临床试验与注册申报,企业不仅能够大幅缩短创新药的上市周期,还能更快满足全球患者的迫切需求。
然而,GDD 并非坦途。法规差异、伦理审批流程、数据整合与跨国沟通等问题,均成为药企迈向国际化道路上的“必答题”。如何平衡速度与合规,如何在复杂的监管环境中实现全球协同,成为本次沙龙聚焦的核心议题。
创思立信:20余年见证行业巨变
作为承办方之一,创思立信集团西南区负责人 Jane Du(杜小芬)在沙龙开场致辞中回顾了公司在生命科学领域的二十余年发展历程:
“在1997年至2017年的20年里,我们主要服务于海外企业进入亚洲及中国市场。而自2017年起,越来越多的中国创新药企开始走向全球,我们的重心也随之转向,致力于陪伴本土药企出海。到2025年,我们的中国客户占比已经超过了海外客户。这个变化,正是中国创新药企全球化浪潮最真实的写照。”

(杜小芬开场致辞)
杜小芬指出,全球同步开发虽充满机遇,但也伴随着复杂挑战——不同国家迥异的法规环境、庞大数据的跨境整合,以及跨语种、多文化沟通的壁垒。作为深耕生命科学领域的语言与技术服务提供商,创思立信将继续发挥桥梁作用,为中国药企的国际化提供合规、精准和高效的支持。
专家共议:策略、实践与未来
在主题分享环节,多位业内专家围绕“全球同步开发”的核心问题进行了深入解读。
复宏汉霖药政注册执行总监文继川指出,虽然中美两大市场的监管体系差异明显,但通过前期科学沟通与战略性设计,企业有可能实现数据互认与并行推进,从而缩短审批周期。

(主题:‘中美同步开发和申报过程中的挑战及经验’)
创思立信生命科学事业部总监朱百珍女士结合自身在翻译和合规支持方面的丰富经验,强调了“从质量、成本到交付”的全流程风险控制她指出,注册申报文件不仅是语言的翻译,更是跨文化、跨体系的专业转化,任何环节的疏忽都可能对项目周期和合规性带来影响。

(主题:‘从质量、成本到交付:注册申报翻译中的风险控制’)
阿斯利康监管事务总监王钊则从跨国药企视角出发,他特别强调早期战略规划的重要性,认为在临床试验设计阶段就应纳入多区域的考量,包括患者招募、数据一致性和监管沟通,以确保研发成果能够顺利进入更多市场。

(线上直播:创新药全球临床开发和注册的关键因素考量)
美国汉佛莱首席运营官赵东结合东南亚及香港市场的实际经验,解析了药品注册策略和路径。他指出,针对不同区域的法规要求及审批流程,企业需要制定差异化方案,从而提高注册效率并降低跨境合规带来的潜在风险。
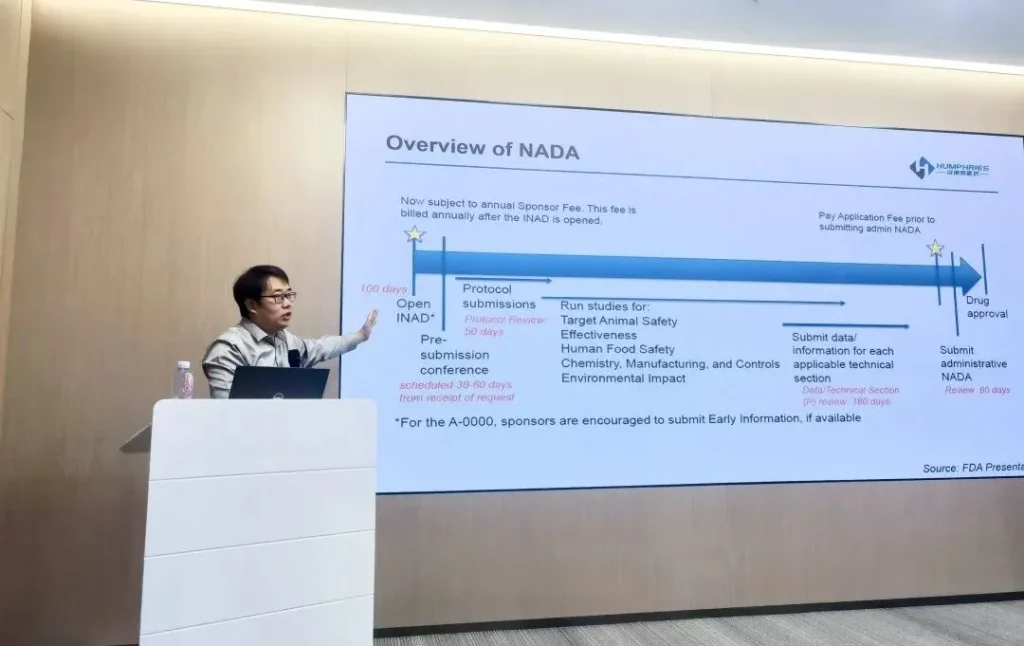
(主题:东南亚及香港药品注册策略和路径解析)
共建全球协同的创新生态
本次沙龙不仅为行业搭建了高层次交流的平台,更为中国创新药企在全球舞台上积累了宝贵的经验与启示。与会嘉宾一致认为,未来的药物研发将不再局限于单一市场,而是依托全球协同创新,共同引领新一轮的产业升级。展望未来,创思立信将携手更多行业伙伴,持续推动全球化研发与协同创新的深入实践,助力中国创新药从实验室走向世界,为全球患者带来更多健康福祉。

(沙龙活动集体合影)
关于创思立信生命科学
创思立信(EC Innovations)为全球领先的医疗与生命科学公司提供了超过 28 年的专业本地化服务,是众多世界级生命科学公司的优选语言服务供应商。我们专注为客户提供生物技术、制药、临床诊断和医疗器械领域的翻译和本地化解决方案,eCTD 申报和国际药政咨询服务。
欲了解更多信息,请访问 EC Innovations 生命科学与医药翻译。





